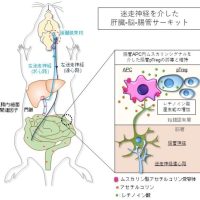
やはり腸内細菌のタイプでがん治療の効果も変わる
目次
第4のがん治療法としての認知度が高まるがん免疫療法。その道を大きく開いたのは2017年ごろから急増した論文だった。ここではサイエンスに掲載された二つの論文の概略を掲載する。翻訳はAI翻訳を使っているため不十分な部分もあることを理解して参考程度に読んでほしい。
➀Gut microbiome modulates response to anti–PD-1 immunotherapy in
melanoma patients
SCIENCE
2 Nov 2017
Vol 359,Issue 6371
pp.97-103
Good bacteria help fight cancer
Resident gut bacteria can affect patient responses to cancer immunotherapy (see the Perspective by Jobin). Routy et al. show that antibiotic consumption is associated with poor response to immunotherapeutic PD-1 blockade. They profiled samples from patients with lung and kidney cancers and found that nonresponding patients had low levels of the bacterium Akkermansia muciniphila. Oral supplementation of the bacteria to antibiotic-treated mice restored the response to immunotherapy. Matson et al. and Gopalakrishnan et al. studied melanoma patients receiving PD-1 blockade and found a greater abundance of “good” bacteria in the guts of responding patients. Nonresponders had an imbalance in gut flora composition, which correlated with impaired immune cell activity. Thus, maintaining healthy gut flora could help patients combat cancer.
Abstract
Preclinical mouse models suggest that the gut microbiome modulates tumor response to checkpoint blockade immunotherapy; however, this has not been well-characterized in human cancer patients. Here we examined the oral and gut microbiome of melanoma patients undergoing anti–programmed cell death 1 protein (PD-1) immunotherapy (n = 112). Significant differences were observed in the diversity and composition of the patient gut microbiome of responders versus nonresponders. Analysis of patient fecal microbiome samples (n = 43, 30 responders, 13 nonresponders) showed significantly higher alpha diversity (P < 0.01) and relative abundance of bacteria of the Ruminococcaceae family (P < 0.01) in responding patients. Metagenomic studies revealed functional differences in gut bacteria in responders, including enrichment of anabolic pathways. Immune profiling suggested enhanced systemic and antitumor immunity in responding patients with a favorable gut microbiome as well as in germ-free mice receiving fecal transplants from responding patients. Together, these data have important implications for the treatment of melanoma patients with immune checkpoint inhibitors.
腸マイクロバイオームはメラノーマ患者における抗PD‐1免疫療法に対する反応を調節する
良質の細菌が癌と闘うのを助ける
常在腸内細菌は、癌免疫療法に対する患者の反応に影響を及ぼす可能性がある(JobinのPerspectiveを参照)。 Routyらは、抗生物質の消費が免疫療法的PD-1遮断に対する不良な反応と関連していることを示している。 同博士らは、肺癌および腎癌患者の検体をプロファイリングし、反応しなかった患者では細菌Akkermansia muciniphilaのレベルが低いことを認めた。 抗生物質投与マウスに細菌を経口補給すると、免疫療法に対する反応が回復した。 MatsonらおよびGopalakrishnanらは、PD-1遮断を受けている黒色腫患者を検討し、奏効した患者の消化管に「良好な」細菌が多いことを見出した。 非応答者は腸内フローラ組成の不均衡があり、これは免疫細胞活性の障害と相関していた。 このように、健全な腸内細菌叢を維持することは、患者が癌と闘うのに役立つ可能性がある。
抄録
前臨床マウスモデルは、腸微生物がチェックポイント阻害剤による免疫療法に対する腫瘍応答を調節することを示唆する;しかし、これはヒト癌患者では十分に特徴付けられていない。 ここでは、PD‐1に対するチェックポイント阻害免疫療法を受けているメラノーマ患者(n = 112)の口腔と腸の微生物を調べた。 応答者対非応答者の患者腸内微生物の多様性と組成に有意差が観察された。
患者の糞便微生物試料(n = 43、応答者30名、非応答者13名)の分析では、応答患者において有意に高いα多様性(P <0.01)およびRuminococcaceaeファミリーの細菌の相対的存在量(P <0.01)が示された。 メタゲノム研究は、同化経路の濃縮を含む応答者における腸内細菌の機能的差異を明らかにした。 免疫プロファイリングから、良好な腸内微生物を有する応答患者ならびに応答患者から糞便移植を受けた無菌マウスにおいて、全身性および抗腫瘍免疫の増強が示唆された。 まとめると、これらのデータは、免疫チェックポイント阻害薬による黒色腫患者の治療に重要な意味をもつ。
➁Gut microbiome
influences efficacy of PD-1-based immunotherapy against epithelial tumors
SCIENCE
2 Nov 2017
Vol 359,Issue 6371
pp.91-97
Good bacteria help fight cancer
Resident gut bacteria can affect patient responses to cancer immunotherapy (see the Perspective by Jobin). Routy et al. show that antibiotic consumption is associated with poor response to immunotherapeutic PD-1 blockade. They profiled samples from patients with lung and kidney cancers and found that nonresponding patients had low levels of the bacterium Akkermansia muciniphila. Oral supplementation of the bacteria to antibiotic-treated mice restored the response to immunotherapy. Matson et al. and Gopalakrishnan et al. studied melanoma patients receiving PD-1 blockade and found a greater abundance of “good” bacteria in the guts of responding patients. Nonresponders had an imbalance in gut flora composition, which correlated with impaired immune cell activity. Thus, maintaining healthy gut flora could help patients combat cancer.
Abstract
Immune checkpoint inhibitors (ICIs) targeting the PD-1/PD-L1 axis induce sustained clinical responses in a sizable minority of cancer patients. We found that primary resistance to ICIs can be attributed to abnormal gut microbiome composition. Antibiotics inhibited the clinical benefit of ICIs in patients with advanced cancer. Fecal microbiota transplantation (FMT) from cancer patients who responded to ICIs into germ-free or antibiotic-treated mice ameliorated the antitumor effects of PD-1 blockade, whereas FMT from nonresponding patients failed to do so. Metagenomics of patient stool samples at diagnosis revealed correlations between clinical responses to ICIs and the relative abundance of Akkermansia muciniphila. Oral supplementation with A. muciniphila after FMT with nonresponder feces restored the efficacy of PD-1 blockade in an interleukin-12–dependent manner by increasing the recruitment of CCR9+CXCR3+CD4+ T lymphocytes into mouse tumor beds.
腸ミクロビオームは上皮性腫瘍に対するPD-1ベースの免疫療法の有効性に影響する
良質の細菌が癌と闘うのを助ける
常在腸内細菌は、癌免疫療法に対する患者の反応に影響を及ぼす可能性がある(JobinのPerspectiveを参照)。 Routyらは、抗生物質の消費が免疫療法的PD-1遮断に対する不良な反応と関連していることを示している。 同博士らは、肺癌および腎癌患者の検体をプロファイリングし、反応しなかった患者では細菌Akkermansia muciniphilaのレベルが低いことを認めた。 抗生物質投与マウスに細菌を経口補給すると、免疫療法に対する反応が回復した。 MatsonらおよびGopalakrishnanらは、PD-1遮断を受けている黒色腫患者を検討し、奏効した患者の消化管に「良好な」細菌が多いことを見出した。 非応答者は腸内フローラ組成の不均衡があり、これは免疫細胞活性の障害と相関していた。 このように、健全な腸内細菌叢を維持することは、患者が癌と闘うのに役立つ可能性がある。
抄録
PD-1/PD-L1軸を標的とする免疫チェックポイント阻害薬(ICI)は、相当数のがん患者において持続的な臨床反応を誘導する。 著者らは、ICIに対する一次耐性が異常な腸内微生物組成に起因する可能性があることを見出した。 抗生物質は進行癌患者におけるICIの臨床的利益を阻害した。 無菌または抗生物質処理マウスへのICIに反応した癌患者からの糞便微生物叢移植(FMT)は、PD‐1遮断の抗腫瘍効果を改善したが、反応しない患者からのFMTはそうしなかった。 診断時の患者の便検体のメタゲノミクスから、ICIに対する臨床反応とAkkermansia muciniphilaの相対的存在量との相関が明らかになった。 ノンレスポンダー糞便によるFMT後のA. muciniphilaの経口補給は、マウス腫瘍床へのCCR9+CXCR3+CD4+ Tリンパ球の動員を増加させることにより、インターロイキン-12依存的にPD-1遮断の有効性を回復させた。
※これらの論文のアブストラクト等はAI翻訳を使っている。そのため、不十分な翻訳となっている部分があり、あくまでも参考程度の日本語となっていることをご了承いただきたい。