自律神経が紡ぐ新しい炎症抑制メカニズムの解明―迷走神経を介した感染症・がん・炎症性腸疾患の治療に新たな光―
目次
慶應義塾大学医学部・日本医療研究開発機構
慶應義塾大学医学部内科学教室(消化器)の金井隆典(かないたかのり)教授、寺谷俊昭特任講師、三上洋平助教を中心とするグループは、同外科学教室(一般・消化器)の北川雄光教授、生理学教室の岡野栄之教授、微生物学・免疫学教室教授の吉村昭彦教授、京都府立大学の岩崎有作教授、九州大学の津田誠教授、金沢医科大学の谷田守准教授、理化学研究所の岡田峰陽チームリーダー、早稲田大学理工学術院の服部正平教授(研究当時)、東京大学の井上将行教授らと共同で、生体には腸管からの腸内細菌情報を肝臓で統合し脳へ伝え、迷走神経反射によって腸管制御性T細胞(pTreg;注1)の産生を制御する機構が存在することを世界で初めて明らかにしました。
今回、マウスにおいて、pTregの分化・維持に極めて重要とされる抗原提示細胞(APC)が腸管粘膜固有層の神経の近傍に多く存在することを明らかにし、さらに腸管APCで高発現の神経伝達物質受容体を特定しました。マウスおよびヒトのAPCをこの受容体の抗原で刺激すると、pTregの分化・誘導に関わる遺伝子の発現が亢進し、腸管粘膜固有層の神経からの伝達を腸管APCを介して受け取り、腸の免疫が抑制される仕組みが示されました。また、マウスの肝臓から脳幹への左迷走神経を人為的に遮断すると、腸管APCを介して亢進される遺伝子発現が障害されることにより、pTreg量が著しく減少することを明らかにしました。さらに、その結果、腸炎マウスモデルでは病態が増悪することがわかりました。これらの結果から、「腸→肝臓→脳→腸相関による迷走神経反射」がpTreg量を調整し、腸の恒常性を維持していることが示されました。
この発見は、腸内環境の変化に起因する現代病(炎症性腸疾患、メタボリックシンドローム、うつ病など)、がん、COVID-19を含む消化管感染症などのさまざまな病気の病態機序の解明や新規治療法の開発に繋がるものとして期待されます。
本研究成果の詳細は、2020年6月11日(英国時間)に英科学誌『Nature』電子版に掲載されました。
研究のポイント
近年、ライフスタイルや環境の急激な変化によって、炎症性腸疾患、メタボリックシンドローム、うつ病、がん、新興感染症などの病気が増加しています。最近では、ライフスタイルの変化に伴う腸内細菌などの腸管環境の乱れが、これらの疾患の主な原因として認識されています。しかし、『病は気から』『医食同源』とはいうものの、腸内細菌を含む腸管環境の変化をどのような仕組みで脳は認識し、病気の発症を抑えているのか、その謎は解明されていませんでした。本研究では、腸内細菌の情報を肝臓が統合し、肝臓→脳→腸管という迷走神経反射を通じて、過剰な炎症を抑える働きをする腸管制御性T細胞(Treg;注1)の産生を制御していることを世界で初めて示しました。本研究のさらなる発展は、増加の一途を辿る現代病、がん、COVID-19など新興感染症の新たな治療法の確立につながると期待されます。
本研究で示したこと
- これまで、腸管制御性T細胞(注1)は末梢(腸管)で産生されると考えられていましたが、今回、脳からの副交感神経(注2)(迷走神経;注3)シグナルの影響を受けていることを明らかにしました。
- 肝臓は腸管環境の情報を集積・統合し、脳へ向かう(求心性)迷走神経を介して脳に腸管環境の情報を伝えていることを明らかにしました。
- ヒトでの検討を加え、腸管で産生される神経伝達物質が腸管の免疫系に作用することを示し、アセチルコリン受容体作動薬・阻害剤による炎症性腸疾患(注4)、がん、COVID-19を含む消化管感染症の治療の可能性を提案しました。
研究の背景と概要
腸管は消化・吸収を司る重要な臓器として機能し、一層の円柱上皮細胞によって外界(管腔)と対峙しています。管腔内では100兆個を越す腸内細菌や食餌抗原など異物に絶えずさらされていますが、腸管内の末梢性制御性T細胞(pTreg:過度の免疫応答を抑える腸管制御性T細胞(Treg)のうち、腸管などの胸腺以外で生まれるもの;注1)の働きにより、過度の炎症応答が起きないように腸管恒常性が維持されています。これまで、pTregの分化・維持には、特定の腸内細菌、腸内細菌由来成分、短鎖脂肪酸(腸内細菌により産出される代謝物)、サイトカイン(免疫細胞から放出される因子)等が重要視されてきました。一方、神経の病気と考えられてきたうつ病や過敏性腸症候群では炎症性腸疾患の発症頻度が比較的高いことから、自律神経(内臓の働きや体温調節などを司る末梢神経)は腸管の免疫異常に深く関与している可能性が示唆されてきました。近年の報告で、神経系が腸管免疫機構へ関与する可能性が示唆されていますが、神経系と腸管pTregの関係は長い間不明でした。また、これまで報告されてきた脳腸相関に関する研究報告では、脳と腸を結ぶ神経回路が具体的に示されておらず解剖学的な観点からも多くの謎が残っていました。本研究では、腸管のpTregは、肝臓−脳−腸相関(liver-brain-gut arc)という新規の迷走神経反射(自律神経によって起こる生体反応)ネットワークによって精巧に制御されていることを世界で初めて報告しました。
研究の成果と意義・今後の展開
本研究では、まず、腸管のpTreg分化・維持に極めて重要とされる抗原提示細胞(APC;注5)が腸管の粘膜固有層内に存在する神経と密接な位置に存在することを見出しました(図1a)。さらに、腸管APCは、脾臓のAPCと異なる神経伝達物質受容体(注6)の遺伝子発現パターンを示し、特にムスカリン型アセチルコリン受容体サブタイプ1(mAChR1;注7)が強く発現しました。腸管のAPCを培養皿上でムスカリンを用いて刺激すると、マウスだけでなくヒトでも、pTregの分化・誘導に関わる遺伝子(レチノイン酸代謝遺伝子)の発現を亢進させました(図1b, c)。
【図1】粘膜固有層の神経周辺にはムスカリン応答性APCが存在する
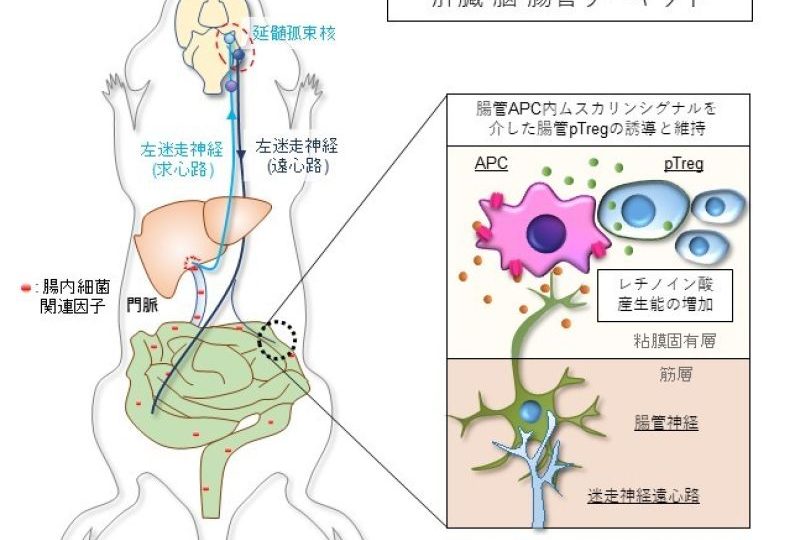
そこで、マウスの迷走神経本幹を外科的に遮断したところ、腸管内のpTregが著しく減少し(図2a)、さらに腸炎モデルマウスでは迷走神経切断により病態が増悪することを確認しました。次に、我々は生体内における神経系と腸管pTregの関係を精査するために、腸管と脳を結ぶ神経回路を探索しました。マウスに大腸炎を発症させた際に活性化する神経を解析したところ、末梢臓器から脳への迷走神経入力系を構成する肝臓内迷走神経、節状神経節、延髄孤束核が活性化していることを見出しました。さらに、細かく分岐している迷走神経をそれぞれ外科的もしくは薬剤を用いて遮断したところ、左迷走神経を構成する迷走神経肝臓枝求心路(肝臓から脳へ情報伝達する感覚神経)が、脳幹の左延髄孤束核に刺激を伝え、左迷走神経背側運動核・左迷走神経遠心路(脳から腸へ刺激を伝える副交感神経)を介する神経反射によって、腸管のAPCを活性化する、という「腸→肝臓→脳→腸相関による迷走神経反射」が、腸管pTregの分化・維持に最も重要であることを明らかにしました(図2b)。
【図2】迷走神経の遮断は腸管のpTregを減少させる
これら迷走神経を遮断したマウスにムスカリン受容体作動薬を投与すると、腸管のpTreg数が回復し、腸炎増悪作用を無効化しました。また、ムスカリン型アセチルコリン受容体を欠損したマウスでは迷走神経肝臓枝の遮断による腸管pTreg低下作用は確認されませんでした。
また、pTregの産生時に重要な腸内細菌を抗生剤で除菌したマウスにおいては、迷走神経肝臓枝の遮断による腸管pTreg減少作用は減弱しました。腸内細菌関連因子に不応答とされるMyd88欠損マウスにおいては、迷走神経肝臓枝の遮断による腸炎病態の増悪作用は確認されませんでした。これらの結果は、迷走神経肝臓枝による腸管pTreg維持において腸内細菌の存在が重要であることを示しています(図3)。
【図3】迷走神経肝臓枝による腸管の恒常性維持には腸内細菌が必要である
腸管から流れ出る血液は、ほとんどが門脈という太い血管に合流して、肝臓に流れ込みます。現在、脳腸相関(“病は気から”)というドグマ仮説が注目されていますが、本研究はこれとは異なり、膨大な腸管情報が、一旦肝臓に集積・統合され、肝臓から自律神経系を介して脳・全身へ連関していることを証明しました。肝臓は、8メートルにもなるヒト腸管内の情報の平均値を正確に集積・統合し、誤作動なく脳へ伝えるインフォメーションセンターとして機能し、腸管免疫が過剰に活性化しないように、腸管の状況に合った適切な指令を脳から腸へフィードバック伝達する機構が存在することを明らかにしました(図4)。ムスカリン型アセチルコリン受容体作動薬・阻害剤の開発は進んでいますが、本発見は、これらの薬剤候補が潰瘍性大腸炎・クローン病など腸の炎症を抑える可能性があり、潰瘍性大腸炎などの治療薬として期待がかかります。さらに、本研究は、腸管での新型コロナウイルスの排除や同ウイルスによる免疫過反応の制御にも応用可能であり、COVID-19治療に応用される可能性もあると考えられます。
【図4】迷走神経肝臓枝を介した腸管pTreg維持機構